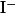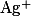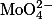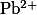При проведении химического процесса чрезвычайно важно бывает проследить за условиями протекания реакции или установить достижение ее окончания. Иногда это удается наблюдать по некоторым внешним признакам: прекращению выделения пузырьков газа, изменению окраски раствора, выпадению осадка или, наоборот, переходу в раствор одного из компонентов реакции и т. п. В большинстве же случаев для определения окончания реакции пользуются реактивами вспомогательного действия, так называемыми индикаторами, которые вводят обычно в анализируемый раствор в небольших количествах.
Индикаторами называются химические соединения, способные изменять окраску раствора в зависимости от условий среды, не влияя при этом непосредственно на испытуемый раствор и на направление реакции. Так, кислотно-щелочные индикаторы изменяют окраску в зависимости от pH среды; окислительно-восстановительные индикаторы — от потенциала среды; адсорбционные индикаторы — от степени адсорбции и т. д.
Особенно широко применяют индикаторы в аналитической практике для титриметрического анализа. Они служат также важнейшим инструментом для контроля технологических процессов в химической, металлургической, текстильной, пищевой и других отраслях промышленности. В сельском хозяйстве при помощи индикаторов проводят анализ и классификацию почв, устанавливают характер удобрений и необходимое количество их для внесения в почву.
Различают кислотно-щелочные, флуоресцентные, окислительновосстановительные, адсорбционные и хемилюминесцентные индикаторы.
КИСЛОТНО-ЩЕЛОЧНЫЕ (PH) ИНДИКАТОРЫ
Как известно из теории электролитической диссоциации, растворенные в воде химические соединения диссоциируют на положительно заряженные ионы — катионы и отрицательно заряженные — анионы. Вода также диссоциирует в очень малой степени на ионы водорода, заряженные положительно, и ионы гидроксила, заряженные отрицательно:
Концентрацию водородных ионов в растворе обозначают символом
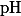
.
Если концентрация водородных и гидроксильных ионов в растворе одинакова, то такие растворы нейтральны и pH = 7. При концентрации водородных ионов, соответствующей pH от 7 до 0, раствор кислый, если же концентрация гидроксильных ионов больше (pH = от 7 до 14), раствор щелочной.
Для измерения значения pH пользуются различными методами. Качественно же реакцию раствора можно определить с помощью специальных индикаторов, меняющих свою окраску в зависимости от концентрации водородных ионов. Такими индикаторами являются кислотно-щелочные индикаторы, которые реагируют на изменение pH среды.
Кислотно-щелочные индикаторы в подавляющем большинстве являются красителями или другими органическими соединениями, молекулы которых претерпевают структурные изменения в зависимости от реакции среды. Ими пользуются в титриметрическом анализе при реакциях нейтрализации, а также для колориметрического определения pH.
| Индикатор |
Интервал pH перехода окраски |
Изменение окраски |
| Метиловый фиолетовый |
0,13—3,2 |
Желтая — фиолетовая |
| Тимоловый синий |
1,2-2,8 |
Красная — желтая |
| Тропеолин 00 |
1,4-3,2 |
Красная — желтая |
 - Динитрофенол - Динитрофенол |
2,4—4,0 |
Бесцветная — желтая |
| Метиловый оранжевый |
3,1-4,4 |
Красная — желтая |
| Нафтиловый красный |
4,0-5,0 |
Красная — оранжевая |
| Метиловый красный |
4,2-6,2 |
Красная — желтая |
| Бромтимоловый синий |
6,0—7,6 |
Желтая — синяя |
| Феноловый красный |
6,8—8,4 |
Желтая — красная |
| Метакрезоловый пурпуровый |
7,4—9,0 |
Желтая — фиолетовая |
| Тимоловый синий |
8,0—9,6 |
Желтая — синяя |
| Фенолфталеин |
8,2—10,0 |
Бесцветная — красная |
| Тимолфталеин |
9,4—10,6 |
Бесцветная — синяя |
| Ализариновый желтый Р |
10,0—12,0 |
Бледно-желтая — красно-оранжевая |
| Тропеолин 0 |
11,0-13,0 |
Желтая — срзнжевая |
| Малахитовый зеленый |
11,6-13,6 |
Зеленовато-голубая — бесцветная |
Если необходимо повысить точность измерения pH, то пользуются смешанными индикаторами. Для этого подбирают два индикатора с близкими интервалами pH перехода окраски, имеющими в этом интервале дополнительные цвета. При помощи такого смешанного индикатора можно проводить определения с точностью до 0,2 единицы pH.
Широко пользуются также универсальными индикаторами, способными многократно изменять окраску в широком диапазоне значений pH. Хотя точность определения такими индикаторами не превышает 1,0 единицы pH, зато они позволяют вести определения в широком интервале pH: от 1,0 до 10,0. Универсальные индикаторы обычно представляют собой комбинацию из четырех — семи двухцветных или одноцветных индикаторов с различными интервалами pH перехода окраски, составленную таким образом, чтобы при изменении pH среды происходило заметное изменение окраски.
Например, выпускаемый промышленностью универсальный индикатор РКС — смесь семи индикаторов: бромкрезолового пурпурового, бромкрезолового зеленого, метилового оранжевого, тро-пеолина 00, фенолфталеина, тимолового синего и бромтимолового синего.
Этот индикатор в зависимости от pH имеет следующую окраску: при pH = 1 — малиновую, pH = 2 — розовато-оранжевую, pH =3 — оранжевую, pH = 4 — желто-оранжевую, pH =5 желтую, pH = 6 — зеленовато-желтую, pH = 7 — желто-зеленую,. РН = 8 — зеленую, pH = 9 — сине-зеленую, pH = 10 — серовато-синюю.
Индивидуальные, смешанные и универсальные кислотно-щелочные индикаторы обычно растворяют в этиловом спирте и по нескольку капель добавляют в испытуемый раствор. По изменению окраски раствора судят о значении pH. Кроме спирторастворимых индикаторов, выпускаются также водорастворимые формы, представляющие собой аммонийные или натриевые соли этих индикаторов.
Во многих случаях удобнее пользоваться не растворами индикаторов, а индикаторными бумажками. Последние готовят следующим образом: фильтровальную бумагу пропускают через стандартный раствор индикатора, отжимают бумагу от избыточного раствора, высушивают, разрезают на узкие полоски и брошюруют в книжечки. Для проведения испытания индикаторную бумажку опускают в испытуемый раствор или одну каплю раствора помещают на полоску индикаторной бумажки и наблюдают изменение ее окраски.
ФЛУОРЕСЦЕНТНЫЕ ИНДИКАТОРЫ
Некоторые химические соединения при воздействии на них ультрафиолетовых лучей обладают способностью при определенном значении pH вызывать флуоресценцию раствора или изменять ее цвет или оттенок.
Этим свойством пользуются для кислотно-щелочного титрования масел, мутных и сильно окрашенных растворов, поскольку обычные индикаторы для этих целей непригодны.
Работу с флуоресцентными индикаторами проводят при освещении исследуемого раствора ультрафиолетовым светом.
| Индикатор |
Интервал pH изменения флуоресценции (в ультрафиолетовом свете) |
Изменение цвета флуоресценции |
| 4-Этоксиакридон |
1,4-3,2 |
Зеленый — синий |
| 2-Нафтиламин |
2,8—4,4 |
Нарастание фиолетовой флуоресценции |
| Диметнлнафтэйродин |
3,2—3,8 |
Лиловый — оранжевый |
| 1-Нафтиламнн |
3,4-4,8 |
Нарастание синей флуоресценции |
| Акридин |
4,8—6,6 |
Зеленый — фиолетовый |
| 3,6-Диоксифталимид |
6,0—8,0 |
Желто-зеленый — желтый |
| 2,3-Дициангидрохинон |
6,8—8,8 |
Синий — зеленый |
| Эухризин |
8,4—10,4 |
Оранжевый — зеленый |
| 1,5-Нафтиламинсульфамид |
9,5—13,0 |
Желтый — зеленый |
| СС-кислота (1,8-аминонафтол 2,4-дисульфокислота) |
10,0-12,0 |
Фиолетовый — зеленый |
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ИНДИКАТОРЫ
Окислительно-восстановительные индикаторы — химические соединения, изменяющие окраску раствора в зависимости от значения окислительно-восстановительного потенциала. Они применяются в титриметрических методах анализа, а также в биологических исследованиях для колориметрического определения окислительно-восстановительного потенциала.
| Индикатор |
Нормальный окислительно-восстановительный потенциал (при рН=7), В |
Окраска раствора |
| |
| |
окислительная форма |
восстановленная форма |
| Нейтральный красный |
—0,330 |
Красно-фиолетовая |
Бесцветная |
| Сафранин Т |
—0,289 |
Коричневая |
Бесцветная |
| Индигомоносульфонат калия |
—0,160 |
Синяя |
Бесцветная |
| Индигодисульфонат калия |
—0,125 |
Синяя |
Бесцветная |
| Индиготрисульфонат калия |
—0,081 |
Синяя |
Бесцветная |
| Инднготетрасульфонат калия |
—0,046 |
Синяя |
Бесцветная |
| Толуидиновый голубой |
+0,007 |
Синяя |
Бесцветная |
| Тнонин |
+0,06 |
Фиолетовая |
Бесцветная |
| о-Крезолиндофенолят натрия |
+0,195 |
Красновато-синяя |
Бесцветная |
| 2,6-Днхлорфенолиндофенолят натрия |
+0,217 |
Красновато-синяя |
Бесцветная |
| м-Бромфенолиндофенолят натрия |
+0,248 |
Красновато-синяя |
Бесцветная |
| Дифеинлбензидин |
+0,76 (кислый раствор) |
Фиолетовая |
Бесцветная |
АДСОРБЦИОННЫЕ ИНДИКАТОРЫ
Адсорбционные индикаторы — вещества, в присутствии которых происходит изменение цвета осадка, образующегося при титровании методом осаждения. Изменять цвет осадка при определенном значении pH способны многие кислотно-щелочные индикаторы, некоторые красители и другие химические соединения, что делает их пригодными для использования в качестве адсорбционных индикаторов.
| Индикатор |
Определяемый ион |
Ион осадитель |
Изменение окраски |
| Ализариновый красный С |
{}^{4-}_6}$) |
 |
Желтая — розово-красная |
| Бромфеноловый синий |
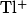 |
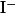 |
Желтая — зеленая |
| |
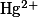 |
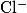 |
Сиреневая — желтая |
| |
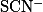 |
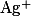 |
Фиолетовая — сине-зеленая |
| Дифенилкарбазид |
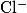 , , 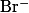 , , |
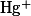 |
Бесцветная — фиолетовая |
| Конго красный |
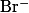 , ,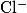 , , |
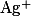 |
Красная — синяя |
| |
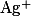 |
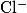 |
Синяя — красная |
| Флуоресцеин |
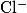 , , 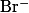 |
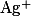 |
Желто-зеленая — розовая |
| Эозин |
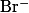 , ,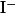 |
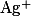 |
Желто-красная — красно фиолетовая |
| Эритрозин |
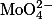 |
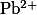 |
Красно-желтая — темно красная |
ХЕМИЛЮМИНЕСЦЕНТНЫЕ ИНДИКАТОРЫ
К этой группе индикаторов относятся вещества, способные при определенных значениях pH высвечивать видимым светом. Хемилюминесцентными индикаторами удобно пользоваться при работе с темными жидкостями, поскольку в данном случае в конечной точке титрования возникает свечение.
| Индикатор |
pH начала свечения |
| Диметилбисакриден |
Около 9,0 |
| Лофин |
8,9—9,4 |
| Люминол |
8,0—8,5 |
| Люцигенин |
9,0-10,0 |
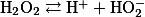
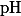 .
.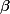 - Динитрофенол
- Динитрофенол{}^{4-}_6}$)
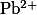
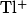
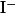
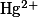
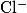
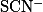
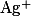
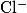 ,
, 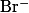 ,
, 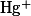
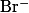 ,
,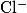 ,
,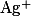
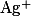
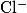
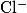 ,
, 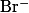
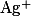
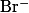 ,
,